美国医疗器械UDI&GUDID注册

2022年9月24日开始,出口美国的医疗器械应在合规时间内,建立产品UDI、包装和标签必须具有UDI码、完成GUDID数据库上传维护,以满足FDA要求。
什么是UDI?
唯一设备标识符(Unique Device Identifier,简称UDI)是一个独特的数字或字母数字代码,用于识别美国市场和世界其他市场上的医疗设备。这些专门的代码被美国食品和药物管理局(FDA)作为其唯一设备识别系统的一部分使用,并提供急需的监管监督。
UDI标记使得每一个设备在整个制造、分销和使用过程中被识别。这个识别系统的目的是为医疗设备行业创建一个统一的国家(和全球)语言,不论产品的相关风险、预期用途或分类。
UDI系统增加了可追溯性,并使医疗器械制造商和FDA官员在病人安全因某一设备问题而受到威胁时能够迅速作出反应。
什么是 UDI 规则?
自 2007 年以来,美国建立 UDI 系统一直是一个持续的过程。FDA 修正法案虽然有延误,但唯一设备识别系统最终规则(UDI 规则) 现在是在美国销售的任何医疗器械的法律要求。
UDI 规则及其相关的唯一设备识别系统受以下约束:
《联邦食品、药品和化妆品法案》(FD&C 法案)第 519(f) 条 (21 USC 360i(f),以及
美国食品药品监督管理局安全与创新法 (FDASIA) 第 614 条
根据 FDA 的说法,该 UDI 规则提供了解决医疗器械制造商以下需求的解决方案:
-减少医疗差错
-简化设备使用信息与数据系统的集成
-提供更快速地识别具有不良事件的医疗器械
-为报告的问题提供更快速的解决方案
-提供更快速、更有效的设备召回解决方案
-提高 FDA 安全沟通的重点和有效性
什么是 UDI 格式?
UDI格式遵循统一的标记系统,一般包括以下内容:
设备标识符 (DI): 一个固定且强制性的部分,用于标识贴标机和设备的特定型号/版本
对于首次申请的公司,DI 编号由 UDI 公司 Dun & Bradstreet 监督的数据通用编号系统 (DUNS) 分配,并可在提出请求后 30 天内分配。
生产标识符(PI): 一个可变部分,表示以下组合:
-生产地
-生产日期
-序列号
-截止日期
§1271.290(c) 要求对作为设备进行监管的人体细胞、组织或基于细胞和组织的产品 (HCT/P) 的不同识别码。
顾名思义,唯一标识符旨在仅对一个设备唯一。这意味着必须在所有一次性设备包装和标签上打印 UDI。
此外,如果设备用于多种用途,则必须将 UDI 直接打印到设备本身上。
UDI 规则还考虑了易于阅读的纯文本和机器可读文本形式的可访问性,以用于自动识别和数据捕获 (AIDC) 技术。

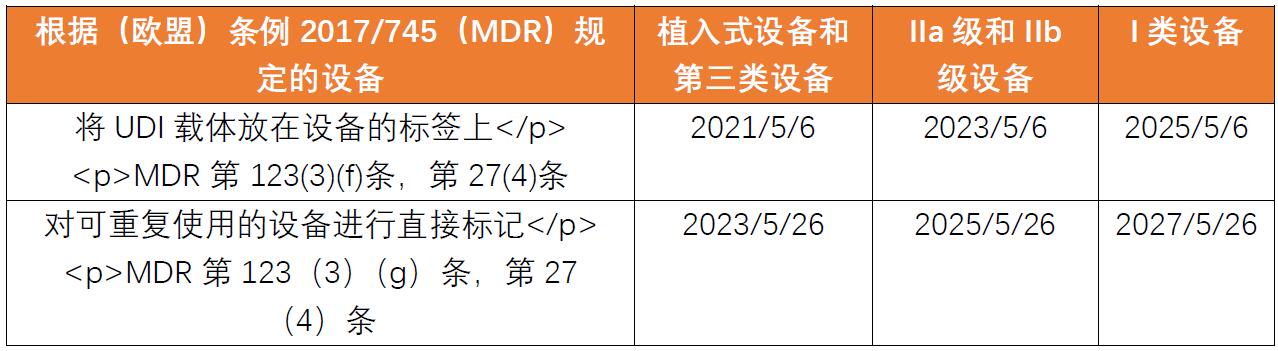
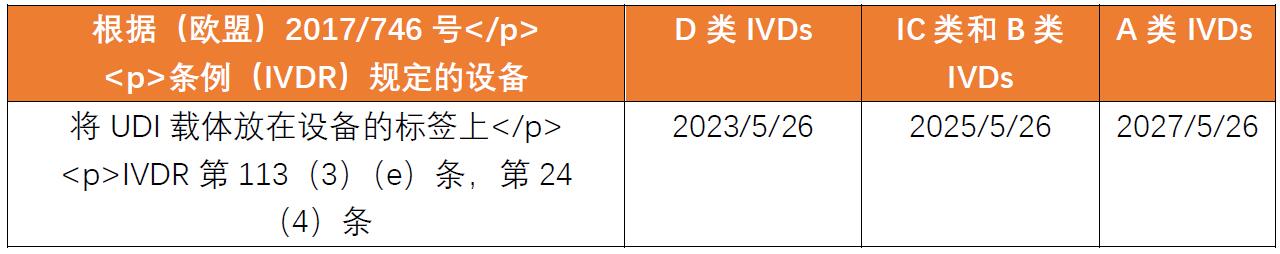
设备符合UDI要求的强制性期限是?
放置UDI载体的义务根据以下时间安排适用。
UDI应该如何出现在设备的标签或包装上?

-UDI载体[数据采集的自动识别(AIDC)和UDI的人类可读解释(HRI)表示]应出现在标签上或设备本身以及所有更高级别的设备包装上。
-如果使用单位包装上有明显的空间限制,UDI载体可以放在下一个高级别的包装上。
-更高级别的包装应具有其独立的UDI。请注意,运输容器免于该要求。
-UDI必须以纯文本版本/人类可读信息(HRI)的形式出现,并采用AIDC技术。AIDC是指以一种可以通过自动程序输入电子病历或其他计算机系统的形式传达唯一设备标识符或设备标识符的任何技术。HRI由可辨认的字符组成,可以很容易地被人阅读。
-如果有重大的限制因素,限制在标签上同时使用AIDC和HRI,则应只要求在标签上出现AIDC格式。
-对于打算在医疗机构之外使用的设备,如家庭护理的设备,HRI应出现在标签上,即使这导致没有空间用于AIDC。
-对于一次性使用的I类和IIa类医疗器械以及A类和B类IVD医疗器械的单独包装和标签,不要求UDI载体出现在包装上,但应出现在更高一级的包装上。例如,一个装有几个(单独包装的)器械的纸箱。然而,在家庭保健环境等情况下,当医疗保健提供者预计无法接触到更高级别的器械包装时,UDI应放在(单个器械的)包装上。
-对于专门用于零售点的设备,AIDC中的UDI- PIs不应要求出现在销售点的包装上。
-如果UDI载体可以通过设备的包装阅读,或者在AIDC的情况下可以扫描,则不要求将UDI载体放在包装上。
医疗器械的哪些变化需要新的UDI-DI?
每当发生可能导致设备识别错误和/或其可追溯性不明确的变化时,就需要一个新的UDI-DI。特别是,在下列要素发生变化的情况下,应要求新的UDI-DI:
-名称或商品名称
-器械版本或型号
-标示为一次性使用
-无菌包装
-使用前需要消毒
-包装中提供的器械数量
-关键警告或禁忌
-CMR/内分泌干扰物
一个UDI-DI应与一个且只有一个基本UDI-DI相关联。
了解更多关于FDA UDI的信息请联系赛德斯威(Satisfy).
